蛋白质
蛋白质(protein)·
通论·
元素组成与分类·
- 组成元素
C、H、O、N、S以及P、Fe、Cu、Zn、Mo、I、Se等
蛋白质平均含氮量为16%,是凯氏定氮法测定蛋白质含量的依据。
此外还有双缩脲法、Lowry法、紫外吸收法、考马氏亮蓝法。
- 分类
蛋白质分子的形状和大小及性质·
- 形状
- 纤维状蛋白
多数不溶于水和稀盐酸
- 球状蛋白
可溶
- 膜蛋白
不溶于水,可溶于去污剂
- 纤维状蛋白
- 大小(测定)
分子量一般在6000-106u
一般将胰岛素视为最小的蛋白质
- 酸碱性
蛋白质是具有两性解离性质的化合物。溶液pH越低,碱性基团解离度越大,反之。
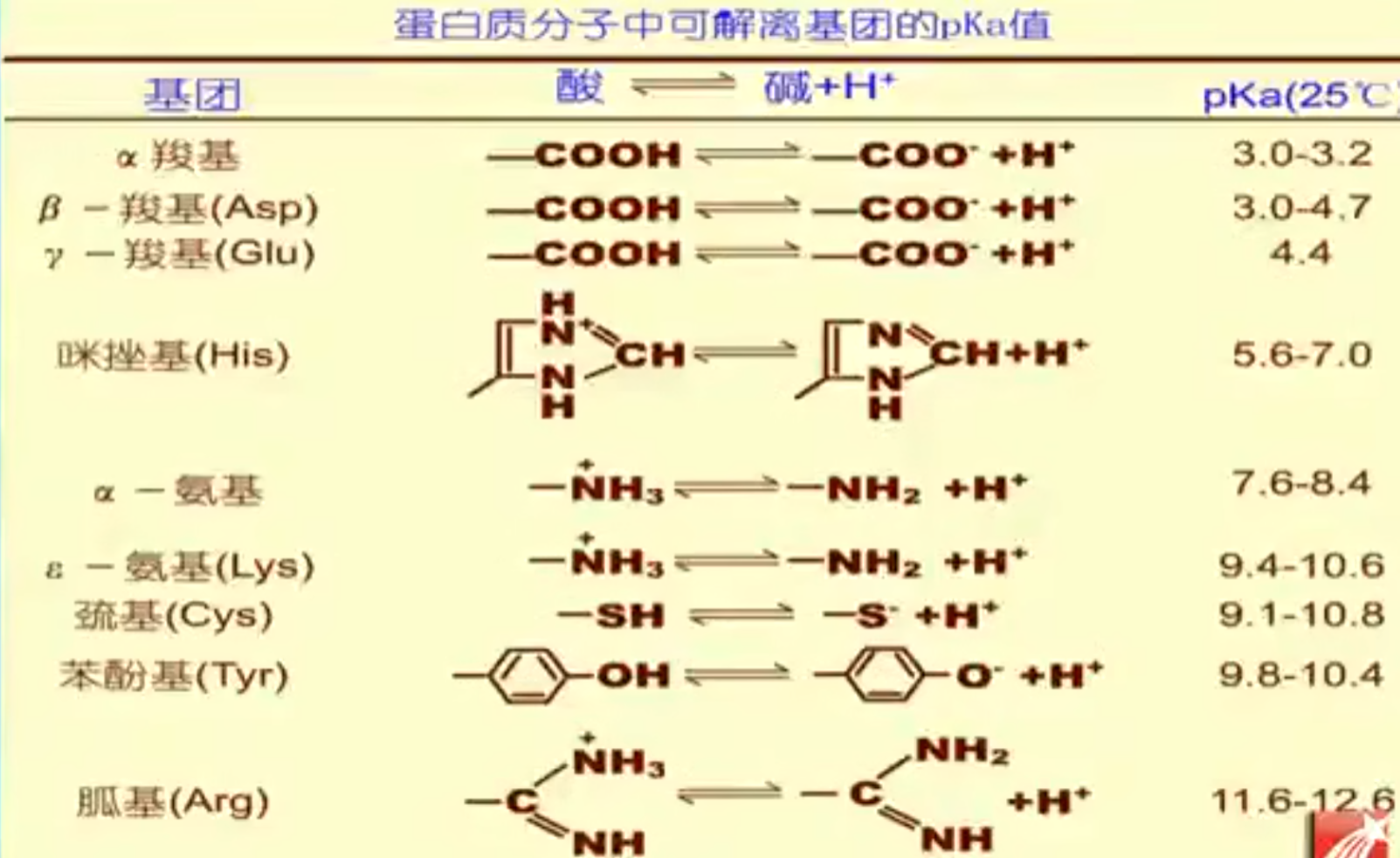
- 等电点(与氨基酸类似)
- 等离子点
指在纯水溶液中,蛋白质溶液的等电点。
- 胶体性质
蛋白质溶液是胶体溶液,其表面存在大量极性基团,亲水性强。稳定是因为双电层,水化层。
- 沉淀
双电层,水化层失效,胶体溶液失去稳定性,絮结沉淀。
- 盐析法
蛋白质脱去水化层。不会使蛋白质变性。
盐溶:在低浓度盐溶液中,蛋白质溶解度增加。 - 加热变性沉淀
蛋白质疏水基外露,损坏水化层。
- 有机溶剂沉淀法
脱去水化层及降低介电系数,增加带电质点间的相互作用。条件:低温操作,缩短时间。
- 重金属盐沉淀法
重金属盐与蛋白质形成复合物。
- 生物碱与某些酸
- 盐析法
- 沉淀
- 变性与复性
变性:在理化(射线、超声波、震荡等)作用下,空间结构遭破坏,丧失生物活性。
复性:某些蛋白质的变性是可逆的。- 旋光值改变
- 特性粘度增加
- 溶解度下降
- 扩散系数降低
- 结晶能力丧失
- 易于消化
共价结构·
肽和肽键·
-
肽(peptide)
由氨基酸的线性聚合物,肽链。具有方向性,氨基端为N端,羧基端为C端。
一般不多于12个残基的肽依次称为1~ 12肽,12~ 20称为寡肽,20+称为多肽。- 肽基C、O、N原子间共振相互作用
由于N原子存在一个孤电子对,其离域可能与羰基碳电子轨道重叠从而形成C=N,也可能与C、O形成离域共价键,还可能不参与成键。
- 结果
- 产生键的平均化(1.25、1.45,平均后1.33nm)
- 形成酰胺基或肽基平面
- 限制肽键的自由旋转
- 肽链呈反式构型
- 结果
- 物理性质
- 肽是离子晶体,熔点较高
- 化学性质
- 至少有一个游离的氨基和羧基,是两性化合物
- 至少有二级解离
- 化学反应
- 双缩脲反应(双肽键)与碱性硫酸铜溶液反应,产生紫红色化合物。
- 肽基C、O、N原子间共振相互作用
-
肽键(peptide bond)
氨基酸的基本连接方式。
结构与功能·
结构层次·
-
一般研究构象方法
- X射线衍射法
- NMR法
- CD法
- 荧光偏振
- 拉曼光谱
- STM
-
维持三维结构的作用力弱的相互作用(非共价力)
- 氢键
- 盐键
- 二硫键
- 疏水作用
- 范德华力
-
多肽主链折叠的空间限制
- 构象角
两个相邻酰胺平面能以共同的碳(Cα)定点旋转,实际酰胺平面与不考虑其他相互作用状态下酰胺平面旋转所成二面角称为构象角。其中Cα相连N原子所构酰胺平面的构象角为φ,Cα相连C原子所构酰胺平面的构象角为ψ。
- ramachandran构象图
以φ、ψ为坐标轴,将所有可能出现的构象情况绘制出来。
- 构象角
一级结构·
蛋白质多肽链中氨基酸残基的排列顺序
测定方法:
- 片段重叠法(分子太大,无法直接测序)
- 测定蛋白质分子的多肽链数目
- 分离蛋白质的多肽链,断开多肽链内的二硫键
- 二硫键断裂
加巯基乙醇
- 通过对角线电泳确定二硫键的位置
原理:降解蛋白质。先电泳一次,可得各片段的带电情况。特异性改变巯基的电荷,往垂直于第一次的方向上再电泳一次。通过对比可得巯基所在片段。
- 二硫键断裂
- 氨基酸组分分析
常在酸水解后,分离,测定各氨基酸的含量。
- 拆分鉴定多肽链N-末端氨基酸残基
- 拆分鉴定多肽链C-末端氨基酸残基
- 肼解法
无水条件下,NH2NH2与蛋白质共热,使肽键降解,生成C-末端氨基酸和氨基酸酰肼。加苯甲醛与之反应生成二苯基衍生物,加水沉淀,分离上层清液。
- 还原法
- 羧肽酶法
羧肽酶A:Arg、Lys、Pro除外的氨基酸残基
羧肽酶B:仅Arg、Lys
羧肽酶C:羟脯氨酸除外的氨基酸残基
羧肽酶Y:所有的氨基酸残基
- 肼解法
- 多肽链裂解
- 酶法裂解
胰蛋白酶(主要切Arg、Lys羧基端肽链)、糜蛋白酶(Phe、Tyr、Trp等)、胃蛋白酶(疏水aa)、弹性蛋白酶(脂肪族aa)
- 化学裂解
- 酶法裂解
- 分析每一条小肽链的氨基酸组成
质谱法
- 通过片段重叠法把小肽链拼回去
通过不同的切割手段获取不同的小肽键序列,对比重叠的片段进行拼接。
- 氨基酸顺序直测法
二级结构·
为蛋白质结构的构象单元。是蛋白质多肽链主链的不同区段,通过相互作用(氢键),会沿某一主轴盘旋、折叠而形成局部的规则构象。
- 螺旋(helix)
- 【H】α折叠
- 右螺旋(L-aa),螺距0.54nm,每3.6个AA残基升一圈
- 所有R基侧链都向外
- 每个氨基酸残基的N-H与前面第三个残基的O=C形成氢键,其取向平行于螺旋轴。肽链上所有肽键参与成氢键。
- Pro和Gly基本不成螺旋
- 【G】3-10_helix
- 【I】π-helix
- 【H】α折叠
- β折叠(β-sheet)
- 【E】β折片(β-strand)平行排列而成
两条或多条伸展的多肽链,形成C=O···H-N,成锯齿状片层结构。即为β折片。
- 【B】reside_in_isolated_β-bridge
- 【E】β折片(β-strand)平行排列而成
- β转角
肽链大于90°的转角
- 【S】hydrogen_bonded_turn
- 【T】bend
- 无规卷曲(coil)
超二级结构·
若干相邻的二级结构彼此作用组合而成的规则可辨组合体。是三级结构的构象单元。
- 类型
- α α
- βαβ
- β β
- rossman折叠
- β曲折
- 希腊钥匙拓扑结构
三级结构(以球状蛋白为例)·
通过侧链基团相互作用,形成次级键,使二级结构相互配置,进一步卷曲折叠,形成特定构象。特定构象使原来肽链所有的原子在空间中重新排布。
- 结构域
对于较大的蛋白质分子或亚基,一般是由两个及以上结构域缔合而成。结构域是有着二级或超二级结构的多肽链形成的三维实体。
结构域与结构域之间存在间隙,可以运动。- 结构单位
- 功能单位
- 折叠单位
- 特征
- 含多种二级结构
- 有明显的结构层次
- 分子表面活性部位
- 疏水区折叠到内部
-
蛋白质的折叠
-
氨基酸序列决定了蛋白质的三级结构
-
体内蛋白质的折叠有异构酶和分子伴侣参与
- 异构酶
PDI催化二硫键正确配对,二硫键对稳定正确折叠起重要作用
- 分子伴侣
是一类蛋白质。通过与部分折叠或不正确折叠的多肽结合,可以简化正确折叠途径并提供折叠微环境。
- Hsp70家族
与伸展多肽疏水区结合,防止肽链不正确折叠;关闭以伸展状态跨膜运输的多肽的折叠。
- Hsp60家族
帮助许多不能自发折叠的蛋白质折叠。
- Hsp70家族
- 异构酶
- 热力学与动力学
$ \Delta G = \Delta H - T\Delta S $
- 蛋白质折叠的方向是向自由能最低的方向
四级结构·
寡聚蛋白质各亚基按一定排布方式缔合而成的蛋白质结构。
-
亚基(单体)
四级结构蛋白质中的每个球状蛋白质。
一般球状三级结构只含一条多肽链,也有二条及以上通过二硫键连接的肽链组成。
- 一个亚基组成的蛋白质称为单体蛋白质。
- 两个及以上亚基组成的蛋白质称为多亚基蛋白质/多聚蛋白质/寡聚蛋白质。
- 单一类型的亚基组成的蛋白质称为同多聚蛋白质。
- 几种类型的亚基组成的蛋白质称为杂多聚蛋白质。
- 对称的寡聚蛋白质可视为由两个及以上不对称的相同结构组成。相同结构叫原体。
对称轴是对称寡聚蛋白质中唯一的对称元素。
使蛋白质复原的最小旋转角为α,有2π/α=n,n为重,对应旋转轴称为n-重轴。
-
维系作用力
- 范德华力
- 疏水键
- 氢键
- 离子键
-
特点
- 增强结构稳定性
- 提高遗传效率和经济性
- 使催化剂基团汇集
- 具有协同性和别构效应
结构与功能的多样性·
序列的多样性决定了结构的多样性导致功能的多样性
- 主要功能
- 催化
- 调节
- 转运
- 储存
- 运动
- 结构
- 支架
- 攻防
- 特殊
结构与功能的关系·
- 同源蛋白质
不同物种间执行相似或相同功能的蛋白质。它们的序列具有明显的相似性,即序列同源性。
相同的残基称为不变残基,不同的残基称为可变残基。
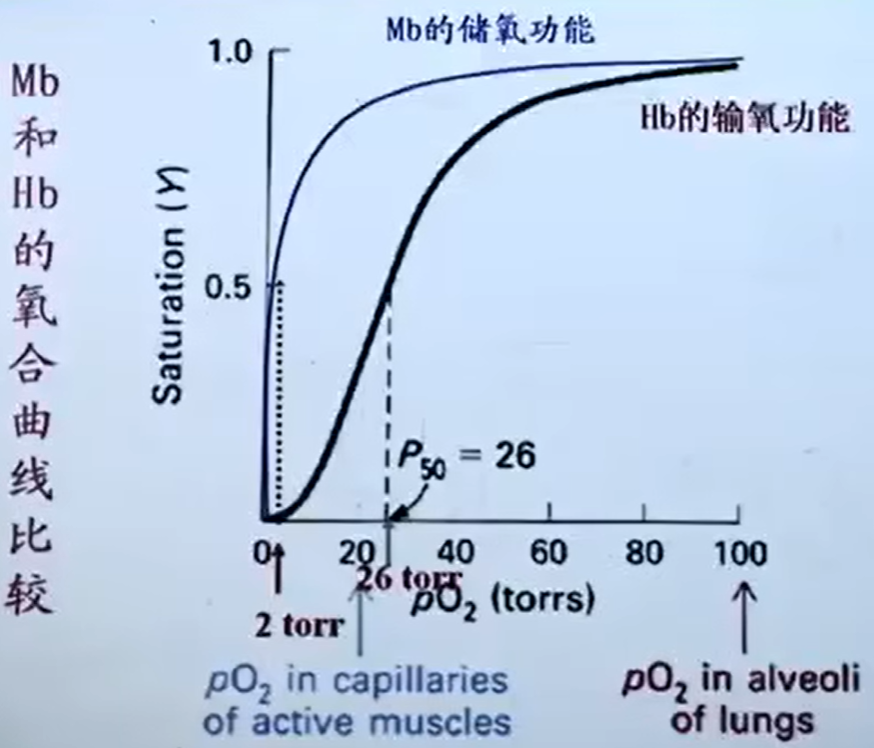
以肌红蛋白与血红蛋白为例
肌红蛋白Mb储氧,血红蛋白Hb运氧
- Hp
多聚蛋白质。
- 正协同性同促效应
血红蛋白中结合了O2用亚基可以增加其他未结合O2的亚基对O2的亲和力。(T构象->R构象)
- 2,3-二磷酸甘油酸 降低 Hb对O2的亲和力
- bohr效应
指pH对血红蛋白氧亲和力的影响(H+/CO2促进O2的释放)
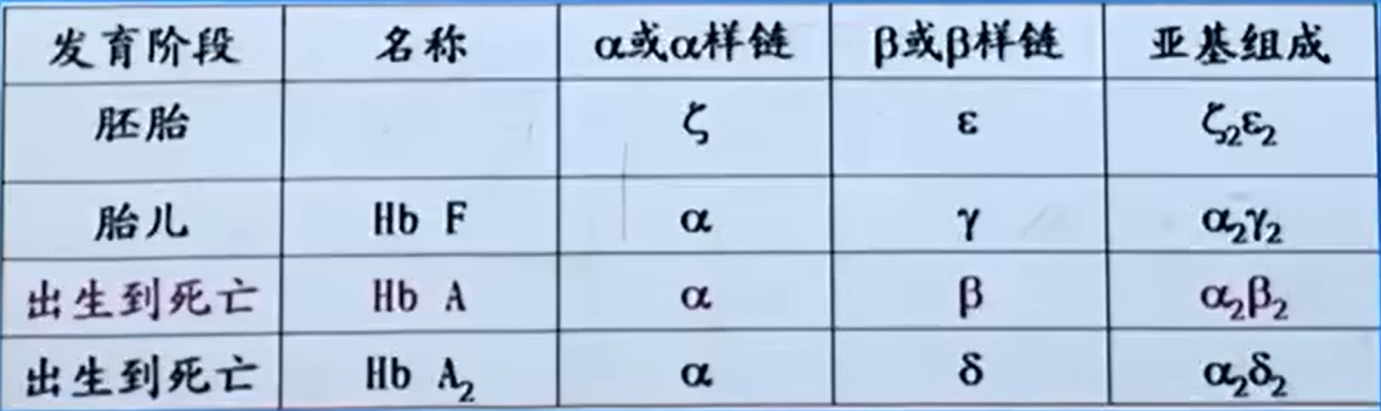
- 血红蛋白在不同年龄的变化
- 正协同性同促效应
- Mb
单体蛋白质。
Mb+O2 ⇌ MbO2 $K = \frac{ [Mb]P_{ O_2 } }{ MbO_2 }$
氧饱 $Y = \frac{ [MbO_2] }{ [Mb]+[MbO_2] }$
则 $[Mb] = \frac{ 1-Y }{ Y } [MbO_2]$
得 $K = \frac{ 1-Y }{ Y } P_{ O_2 }$
所以 $Y = \frac{ P_{ O_2 } }{ P_{ O_2 }+K }$
Hb+nO2 ⇌ Hb(O2)n
类似的有 $Y = \frac{ P_{ O_2 }^n }{ P_{ O_2 }^n+K }$
分离与纯化·
测定·
- 测定相对分子量
- 化学分析测定
通过化学分析测定蛋白质中某一微量元素的含量,假设分子中有一个被测元素原子,从而推算出蛋白质的最低分子量。
- 渗透压测定
$ \displaystyle Mr = \frac{ RT }{ \displaystyle\lim_{ c \rightarrow 0 } \frac{ \pi }{ c } }$
Mr在10-100kDa。c的单位是g/mol - 沉降分析测定
沉降系数(S20,W):单位离心场中沉降的速度。1S = 10-13s
- 沉降速度法
在离心场中,若ρ蛋白质 > ρ溶液 则蛋白质沉降。
$Mr = \frac{ RTS }{ D(1-V_\rho) }$ (D为扩散系数,V是偏微分比容) - 沉降平衡法
在较低速度下长时间离心,先使蛋白质颗粒沉降些许以形成浓度差,随后在扩散作用下,使之沉降与扩散平衡。
$Mr = \frac{ 2RTln(\frac{ C_2 }{ C_1 }) }{ \omega2(1-V_\rho)(x_22-x_1^2) }$
- 沉降速度法
- 凝胶过滤法
用交联葡聚糖,测分子量大小。
- SDS-PAGE法
sds聚丙烯酰胺凝胶电泳,按蛋白质各组分电泳迁移率不同,分析蛋白质。
- 化学分析测定
分离纯化·
- 一般原则
- 据分子量(沉降速度法)
- 据密度(沉降平衡法)
- 据电荷(等电点沉淀)
- 据分子量及电荷(SDS-PAGE法)
- 据分子量及分子形状(凝胶过滤)
- 据溶解度(化学分析)
- 方法
- 透析
通过半透膜过滤,纯化蛋白质。
- 超过滤
压力和离心力强行使小分子物质通过半透膜以纯化蛋白质。
- 凝胶过滤法
- 等电点沉淀法
- 盐析
- 温度分离
- 有机溶剂分级分离
- 电泳
- 离子交换层析
- 亲和层析
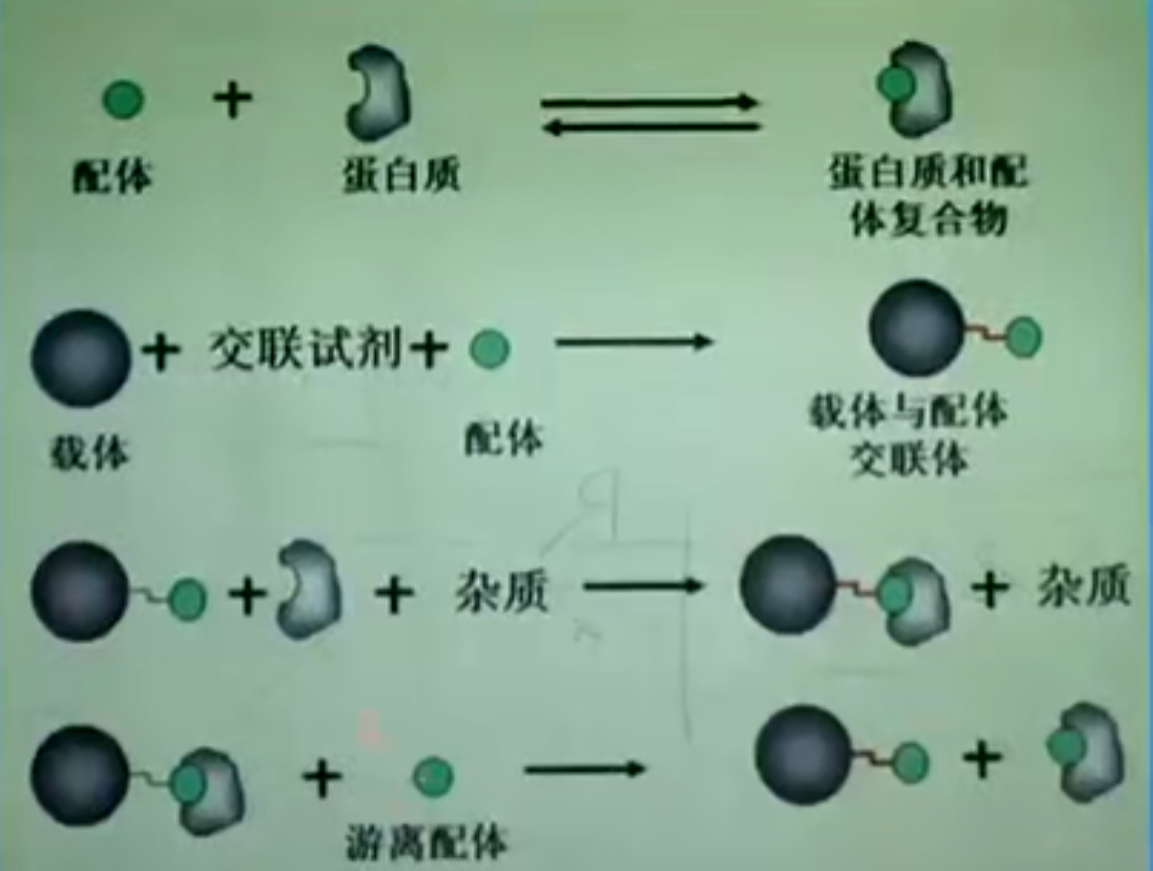
- 透析
- 纯度鉴定
- 电泳
- 沉淀
- HPLC
- N末端测序
考点总结及名词解释·
有待补充
